रॉयल स्वीडिश एकेडमी ऑफ साइंसेज ने रसायन विज्ञान में 2024 का # नोबेल पुरस्कार देने का फैसला किया है, जिसमें आधा हिस्सा डेविड बेकर को “कम्प्यूटेशनल प्रोटीन डिजाइन के लिए” और दूसरा आधा हिस्सा डेमिस हसाबिस और जॉन एम. जम्पर को “प्रोटीन संरचना भविष्यवाणी के लिए” संयुक्त रूप से दिया जाएगा।

रसायनज्ञों ने लंबे समय से जीवन के रासायनिक उपकरणों – प्रोटीन को पूरी तरह से समझने और उस पर महारत हासिल करने का सपना देखा है। यह सपना अब पहुंच के भीतर है। डेमिस हसबिस और जॉन एम. जम्पर ने लगभग सभी ज्ञात प्रोटीन की संरचना की भविष्यवाणी करने के लिए कृत्रिम बुद्धिमत्ता(AI) का सफलतापूर्वक उपयोग किया है। डेविड बेकर ने सीखा है कि जीवन के मूलभूत घटको में महारत कैसे हासिल की जाए और पूरी तरह से नए प्रोटीन कैसे बनाए जाएं। उनकी खोजों का महत्व और कार्यक्षमता बहुत अधिक है।
कंप्यूटिंग और कृत्रिम बुद्धिमत्ता के माध्यम से प्रोटीन के रहस्यों की व्याख्या
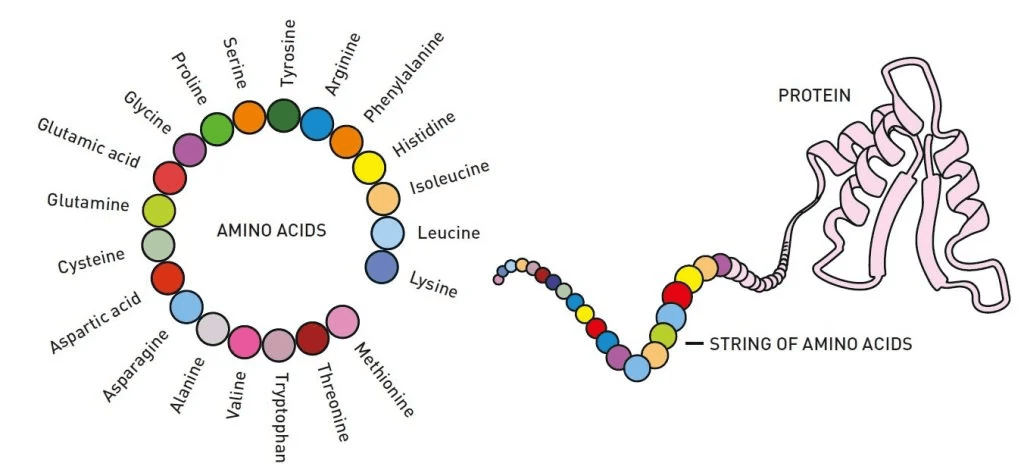
जीवन का रसायन विज्ञान कैसे संभव होता है? इस प्रश्न का उत्तर प्रोटीन का अस्तित्व है, जिसे शानदार रासायनिक औजार के रूप में बताया जा सकता है। वे आम तौर पर 20 अमीनो एसिड से बने होते हैं जिन्हें अंतहीन तरीकों से जोड़ा जा सकता है। डीएनए में संग्रहीत जानकारी को ब्लूप्रिंट के रूप में उपयोग करते हुए, अमीनो एसिड को हमारी कोशिकाओं में एक साथ जोड़कर लंबी स्ट्रिंग बनाई जाती है।
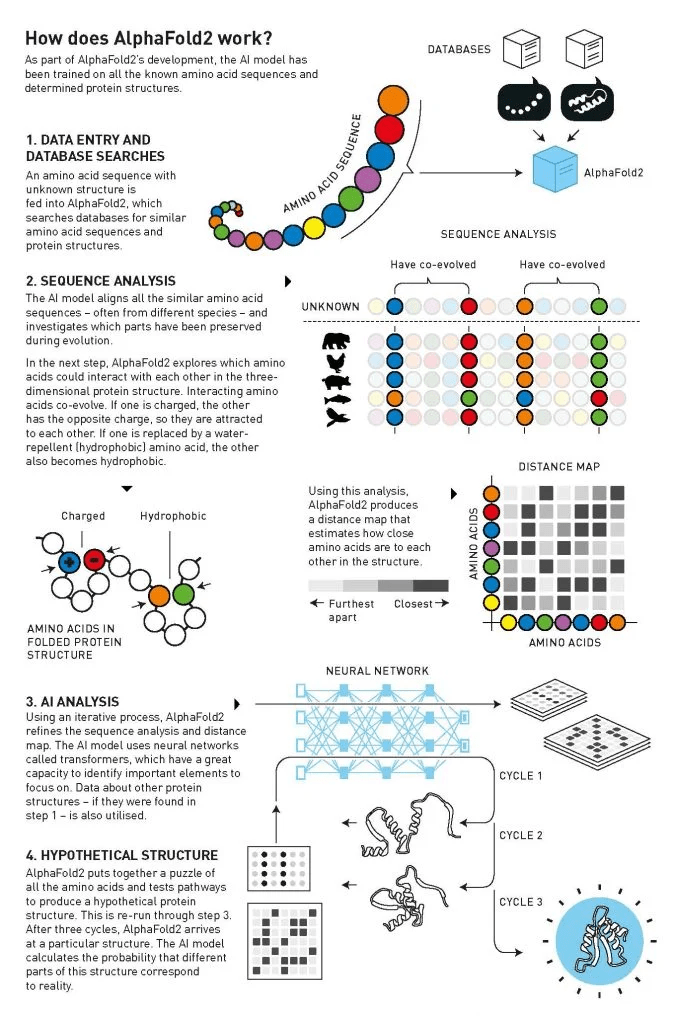
फिर प्रोटीन का जादू होता है: अमीनो एसिड की स्ट्रिंग एक अलग – कभी-कभी अनोखी – त्रि-आयामी संरचना (चित्र 1) में मुड़ती और मुड़ती है। यह संरचना प्रोटीन को उनका कार्य देती है। कुछ रासायनिक निर्माण इकाइयां बन जाती हैं जो मांसपेशियों, सींग या पंख बना सकते हैं, जबकि अन्य हार्मोन या एंटीबॉडी बन सकते हैं। उनमें से कई एंजाइम बनाते हैं, जो जीवन की रासायनिक प्रतिक्रियाओं को आश्चर्यजनक सटीकता के साथ संचालित करते हैं। कोशिकाओं की सतहों पर बैठे प्रोटीन भी महत्वपूर्ण हैं, और कोशिका और उसके आस-पास के वातावरण के बीच संचार चैनल के रूप में कार्य करते हैं।
जीवन के रासायनिक निर्माण खंडों, इन 20 अमीनो एसिड द्वारा शामिल की गई क्षमता को कम कर के दर्शाना संभव नहीं है। रसायन विज्ञान में 2024 का नोबेल पुरस्कार उन्हें पूरी तरह से नए स्तर पर समझने और उनके प्रयोग में महारत हासिल करने के बारे में है। पुरस्कार का आधा हिस्सा डेमिस हसबिस और जॉन जम्पर को जाता है, जिन्होंने कृत्रिम बुद्धिमत्ता का उपयोग करके एक ऐसी समस्या को सफलतापूर्वक हल किया है, जिससे रसायनज्ञ 50 से अधिक वर्षों से जूझ रहे थे:
अमीनो एसिड के अनुक्रम से प्रोटीन की त्रि-आयामी संरचना की भविष्यवाणी करना।
इसने उन्हें लगभग सभी 200 मिलियन ज्ञात प्रोटीन की संरचना की व्याख्या करने क्षमता प्रदान की है।
पुरस्कार का दूसरा आधा हिस्सा डेविड बेकर को दिया जाता है। उन्होंने वह हासिल करने के लिए कम्प्यूटरीकृत तरीके विकसित किए हैं, जिसे कई लोग असंभव मानते थे:
ऐसे प्रोटीन बनाना जो पहले मौजूद नहीं थे और जो पूरी तरह से अनेक गुणों के आधार पर नए कार्य हैं।
रसायन विज्ञान में 2024 का नोबेल पुरस्कार दो अलग-अलग खोजों को मान्यता देता है, लेकिन जैसा कि आप देखेंगे, वे आपस में निकटता से जुड़ी हुई हैं। इस वर्ष के विजेताओं ने जिन चुनौतियों का सामना किया है, उन्हें समझने के लिए हमें आधुनिक जैव रसायन विज्ञान की शुरुआत को देखना होगा।
प्रोटीन की पहली धुंधली तस्वीरें
रसायनज्ञों को उन्नीसवीं सदी से ही पता है कि प्रोटीन जीवन की प्रक्रियाओं के लिए महत्वपूर्ण हैं, लेकिन शोधकर्ताओं को प्रोटीन के बारे में अधिक विस्तार से जानने के लिए रासायनिक उपकरणों को सटीक बनाने में 1950 का दशक लग गया। कैम्ब्रिज के शोधकर्ता जॉन केंड्रू और मैक्स पेरुट्ज़ ने एक महत्वपूर्ण खोज की, जब दशक के अंत में उन्होंने प्रोटीन के पहले त्रि-आयामी मॉडल को प्रस्तुत करने के लिए एक्स-रे क्रिस्टलोग्राफी नामक विधि का सफलतापूर्वक उपयोग किया। इस खोज के सम्मान में, उन्हें 1962 में रसायन विज्ञान में नोबेल पुरस्कार से सम्मानित किया गया।
इसके बाद, शोधकर्ताओं ने मुख्य रूप से एक्स-रे क्रिस्टलोग्राफी का उपयोग किया है – और अक्सर बहुत अधिक प्रयास के साथ – लगभग 200,000 विभिन्न प्रोटीनों की छवियों का सफलतापूर्वक उत्पादन किया है, जिसने 2024 में रसायन विज्ञान में नोबेल पुरस्कार की नींव रखी।
एक पहेली: प्रोटीन अपनी विशिष्ट संरचना कैसे पाता है?
अमेरिकी वैज्ञानिक क्रिश्चियन एनफिन्सन ने एक और प्रारंभिक खोज की। विभिन्न रासायनिक तरकीबों का उपयोग करके, वह एक मौजूदा प्रोटीन को खोलने और फिर से मोड़ने में कामयाब रहे। दिलचस्प अवलोकन यह था कि प्रोटीन हर बार बिल्कुल एक ही आकार ग्रहण करता था। 1961 में, उन्होंने निष्कर्ष निकाला कि प्रोटीन की त्रि-आयामी संरचना पूरी तरह से प्रोटीन में अमीनो एसिड के अनुक्रम द्वारा नियंत्रित होती है। इसके कारण उन्हें 1972 में रसायन विज्ञान में नोबेल पुरस्कार से सम्मानित किया गया।
हालाँकि, एनफिन्सन के तर्क में एक विरोधाभास है, जिसे एक अन्य अमेरिकी, साइरस लेविंथल ने 1969 में इंगित किया था। उन्होंने गणना की कि भले ही एक प्रोटीन में केवल 100 अमीनो एसिड हों, सिद्धांत रूप में प्रोटीन कम से कम 1047 विभिन्न त्रि-आयामी संरचनाओं को ग्रहण कर सकता है। यदि अमीनो एसिड की श्रृंखला को बेतरतीब ढंग से मोड़ा जाए, तो सही प्रोटीन संरचना को खोजने में ब्रह्मांड की आयु से अधिक समय लगेगा। एक कोशिका में, इसमें बस कुछ मिलीसेकंड लगते हैं। तो अमीनो एसिड की स्ट्रिंग वास्तव में कैसे मुड़ती है? एन्फिन्सन की खोज और लेविनथल के विरोधाभास ने यह संकेत दिया कि फोल्डिंग एक पूर्व निर्धारित प्रक्रिया है। और – महत्वपूर्ण बात – प्रोटीन फोल्ड्स के बारे में सारी जानकारी अमीनो एसिड अनुक्रम में मौजूद होनी चाहिए।
जैव रसायन विज्ञान की महान चुनौती के लिए चुनौती पेश करना
उपरोक्त अंतर्दृष्टि ने एक और निर्णायक अहसास को जन्म दिया – यदि रसायनज्ञों को प्रोटीन के अमीनो एसिड अनुक्रम का पता है, तो उन्हें प्रोटीन की त्रि-आयामी संरचना की भविष्यवाणी करने में सक्षम होना चाहिए। यह एक रोमांचक विचार था। यदि वे सफल होते, तो उन्हें अब जटिल एक्स-रे क्रिस्टलोग्राफी का उपयोग नहीं करना पड़ता और वे बहुत समय बचा सकते थे। वे उन सभी प्रोटीनों के लिए संरचनाएँ भी बना सकते थे जहाँ एक्स-रे क्रिस्टलोग्राफी लागू नहीं थी।
इन तार्किक निष्कर्षों ने जैव रसायन विज्ञान की सबसे बड़ी चुनौती बन चुकी चुनौती को चुनौती दी: भविष्यवाणी की समस्या। इस क्षेत्र में और अधिक तेजी से विकास को प्रोत्साहित करने के लिए, 1994 में शोधकर्ताओं ने प्रोटीन संरचना भविष्यवाणी का महत्वपूर्ण आकलन (CASP) नामक एक परियोजना शुरू की, जो एक प्रतियोगिता में विकसित हुई। हर दूसरे वर्ष, दुनिया भर के शोधकर्ताओं को प्रोटीन में अमीनो एसिड के अनुक्रमों तक पहुँच दी जाती थी जिनकी संरचनाएँ अभी-अभी निर्धारित की गई थीं। हालाँकि, संरचनाओं को प्रतिभागियों से गुप्त रखा गया था। चुनौती ज्ञात अमीनो एसिड अनुक्रमों के आधार पर प्रोटीन संरचनाओं की भविष्यवाणी करना था।
CASP ने कई शोधकर्ताओं को आकर्षित किया, लेकिन भविष्यवाणी की समस्या को हल करना अविश्वसनीय रूप से कठिन साबित हुआ। प्रतियोगिता में शोधकर्ताओं द्वारा दर्ज की गई भविष्यवाणियों और वास्तविक संरचनाओं के बीच पत्राचार में शायद ही कोई सुधार हुआ हो। सफलता केवल 2018 में मिली, जब एक शतरंज मास्टर, तंत्रिका विज्ञान विशेषज्ञ और कृत्रिम बुद्धिमत्ता के अग्रणी ने इस क्षेत्र में प्रवेश किया।
शतरंज मास्टर का प्रोटीन ओलंपिक में प्रवेश
आइए डेमिस हसबिस की पृष्ठभूमि पर एक नज़र डालते हैं: उन्होंने चार साल की उम्र में शतरंज खेलना शुरू किया और 13 साल की उम्र में मास्टर लेवल हासिल किया। अपनी किशोरावस्था में, उन्होंने एक प्रोग्रामर और सफल गेम डेवलपर के रूप में अपना करियर शुरू किया। उन्होंने कृत्रिम बुद्धिमत्ता की खोज शुरू की और तंत्रिका विज्ञान को अपनाया, जहाँ उन्होंने कई क्रांतिकारी खोजें कीं। उन्होंने मस्तिष्क के बारे में जो कुछ सीखा, उसका उपयोग उन्होंने AI के लिए बेहतर तंत्रिका नेटवर्क विकसित करने के लिए किया। 2010 में उन्होंने डीपमाइंड की सह-स्थापना की, एक ऐसी कंपनी जिसने लोकप्रिय बोर्डगेम के लिए बेहतरीन AI मॉडल विकसित किए। कंपनी को 2014 में Google को बेच दिया गया और दो साल बाद, डीपमाइंड वैश्विक ध्यान में आया जब कंपनी ने वह हासिल किया जिसे तब कई लोग AI की असंभव उपलब्धि मानते थे: दुनिया के सबसे पुराने बोर्डगेम में से एक, गो(Go) के चैंपियन खिलाड़ी को हराना।
हालाँकि, हसबिस के लिए, गो लक्ष्य नहीं था, यह बेहतर AI मॉडल विकसित करने का साधन था। इस जीत के बाद, उनकी टीम मानवता के लिए अधिक महत्व की समस्याओं से निपटने के लिए तैयार थी, इसलिए 2018 में उन्होंने तेरहवीं CASP प्रतियोगिता के लिए पंजीकरण कराया।
डेमिस हसबिस के एआई मॉडल की अप्रत्याशित जीत
पिछले वर्षों में, शोधकर्ताओं ने CASP के लिए जिन प्रोटीन संरचनाओं की भविष्यवाणी की थी, उनमें अधिकतम 40 प्रतिशत की सटीकता प्राप्त हुई थी। अपने AI मॉडल, अल्फाफोल्ड के साथ, हसबिस की टीम लगभग 60 प्रतिशत तक पहुंच गई। वे जीत गए, और उत्कृष्ट परिणाम ने कई लोगों को आश्चर्यचकित कर दिया – यह अप्रत्याशित प्रगति थी, लेकिन समाधान अभी भी पर्याप्त नहीं था। सफलता के लिए, लक्ष्य संरचना की तुलना में भविष्यवाणी की सटीकता 90 प्रतिशत होनी चाहिए।
हसबिस और उनकी टीम ने अल्फाफोल्ड का विकास जारी रखा – लेकिन, उन्होंने कितनी भी कोशिश की, एल्गोरिदम कभी भी पूरी तरह से सफल नहीं हुआ। कठोर सच्चाई यह थी कि वे एक निराशाजनक अंत पर आ गए थे। टीम थक गई थी, लेकिन एक नए कर्मचारी “जॉन जम्पर” के पास इस बारे में कुछ नए विचार थे कि एआई मॉडल को कैसे बेहतर बनाया जा सकता है।
जॉन जम्पर द्वारा जैवरसायन(बायोकेमिस्ट्री) की चुनौती का सामना
ब्रह्मांड के प्रति जॉन जम्पर के आकर्षण ने उन्हें भौतिकी और गणित का अध्ययन करने के लिए प्रेरित किया। हालाँकि, 2008 में, जब उन्होंने एक ऐसी कंपनी में काम करना शुरू किया जो प्रोटीन और उनकी गतिशीलता का अनुकरण करने के लिए सुपर कंप्यूटर का उपयोग करती थी, तो उन्हें एहसास हुआ कि भौतिकी का ज्ञान चिकित्सा समस्याओं को हल करने में मदद कर सकता है।
प्रोटीन में इस नई अर्जित रुचि को जम्पर ने अपने साथ तब लिया जब 2011 में उन्होंने सैद्धांतिक भौतिकी में डॉक्टरेट की पढ़ाई शुरू की। कंप्यूटर की क्षमता को बचाने के लिए – जो विश्वविद्यालय में कम आपूर्ति में थी – उन्होंने प्रोटीन की गतिशीलता का अनुकरण करने के लिए सरल और अधिक सरल तरीके विकसित करना शुरू कर दिया। जल्द ही, उन्होंने भी जैव रसायन विज्ञान की बड़ी चुनौती का सामना किया। 2017 में, उन्होंने हाल ही में अपनी डॉक्टरेट पूरी की थी जब उन्होंने अफ़वाहें सुनीं कि Google DeepMind ने बहुत ही गोपनीयता के साथ प्रोटीन संरचनाओं की भविष्यवाणी करना शुरू कर दिया है। उन्होंने उन्हें नौकरी के लिए आवेदन भेजा। प्रोटीन सिमुलेशन के उनके अनुभव का मतलब था कि उनके पास अल्फाफोल्ड को बेहतर बनाने के बारे में रचनात्मक विचार थे, इसलिए जब टीम ने काम करना शुरू किया, तो उन्हें पदोन्नत कर दिया गया। जम्पर और हसबिस ने उस कार्य का सह-नेतृत्व किया, जिसने एआई मॉडल में मौलिक सुधार किया।
सुधारित AI मॉडल से आश्चर्यजनक परिणाम
नया संस्करण – अल्फाफोल्ड2 – जम्पर के प्रोटीन के ज्ञान से रंगा हुआ था। टीम ने हाल ही में AI में हुई बड़ी सफलता के पीछे ट्रांसफॉर्मर नामक न्यूरल नेटवर्क खोज का उपयोग भी है । ये पहले की तुलना में अधिक लचीले तरीके से भारी मात्रा में डेटा में पैटर्न ढूंढ सकते हैं, और कुशलतापूर्वक निर्धारित कर सकते हैं कि किसी विशेष लक्ष्य को प्राप्त करने के लिए किस पर ध्यान केंद्रित किया जाना चाहिए।
टीम ने सभी ज्ञात प्रोटीन संरचनाओं और अमीनो एसिड अनुक्रमों (चित्र ) के डेटाबेस में विशाल जानकारी पर अल्फाफोल्ड2 को प्रशिक्षित किया और नई AI वास्तुकला ने चौदहवीं CASP प्रतियोगिता के लिए समय पर अच्छे परिणाम देने शुरू कर दिए।
2020 में, जब CASP के आयोजकों ने परिणामों का मूल्यांकन किया, तो उन्होंने समझा कि जैव रसायन विज्ञान की 50 साल पुरानी चुनौती खत्म हो गई है। ज्यादातर मामलों में, अल्फाफोल्ड2 ने एक्स-रे क्रिस्टलोग्राफी के लगभग बराबर प्रदर्शन किया, जो आश्चर्यजनक था। जब CASP के संस्थापकों में से एक, जॉन मौल्ट ने 4 दिसंबर 2020 को प्रतियोगिता का समापन किया, तो उन्होंने पूछा – अब क्या?
हम उस पर वापस आएंगे। अब हम समय में पीछे जाकर CASP के एक और प्रतिभागी पर प्रकाश डालेंगे। आइए रसायन विज्ञान में 2024 के नोबेल पुरस्कार के दूसरे भाग को प्रस्तुत करते हैं, जो नए प्रोटीन को खरोंच से बनाने की कला से संबंधित है।
कोशिका के बारे में एक पाठ्यपुस्तक ने डेविड बेकर को दिशा बदलने पर मजबूर कर दिया
जब डेविड बेकर ने हार्वर्ड विश्वविद्यालय में अध्ययन करना शुरू किया, तो उन्होंने दर्शनशास्त्र और सामाजिक विज्ञान को चुना। हालाँकि, विकासवादी जीव विज्ञान के एक कोर्स के दौरान उन्हें “क्लासिक पाठ्यपुस्तक मॉलिक्यूलर बायोलॉजी ऑफ़ द सेल” का पहला संस्करण मिला। इससे उन्हें जीवन में अपनी दिशा बदलने के लिए प्रेरित किया। उन्होंने कोशिका जीव विज्ञान का पता लगाना शुरू किया और अंततः वे प्रोटीन संरचनाओं से मोहित हो गए। जब, 1993 में, उन्होंने सिएटल में वाशिंगटन विश्वविद्यालय में समूह के नेता के रूप में शुरुआत की, तो उन्होंने जैव रसायन विज्ञान की बड़ी चुनौती को स्वीकार किया। चतुर प्रयोगों का उपयोग करते हुए, उन्होंने यह पता लगाना शुरू किया कि प्रोटीन कैसे मुड़ते हैं। इससे उन्हें अंतर्दृष्टि मिली, जिसे उन्होंने 1990 के दशक के अंत में अपने साथ ले लिया, जब उन्होंने प्रोटीन संरचनाओं की भविष्यवाणी करने वाला कंप्यूटर सॉफ़्टवेयर विकसित करना शुरू किया: रोसेटा।
बेकर ने 1998 में रोसेटा का उपयोग करके CASP प्रतियोगिता में अपनी शुरुआत की और अन्य प्रतिभागियों की तुलना में, यह वास्तव में अच्छा प्रदर्शन किया। इस सफलता ने एक नए विचार को जन्म दिया – कि डेविड बेकर की टीम सॉफ़्टवेयर का उल्टा उपयोग कर सकती है। रोसेट्टा में अमीनो एसिड अनुक्रमों को दर्ज करने और प्रोटीन संरचनाएं प्राप्त करने के बजाय, उन्हें एक वांछित प्रोटीन संरचना में प्रवेश करने और इसके अमीनो एसिड अनुक्रम के लिए सुझाव प्राप्त करने में सक्षम होना चाहिए, जो उन्हें पूरी तरह से नए प्रोटीन बनाने की अनुमति देगा।
बेकर प्रोटीन निर्माता बन गए
प्रोटीन डिजाइन का क्षेत्र – जहाँ शोधकर्ता नए कार्यों के साथ विशेष प्रोटीन बनाते हैं – 1990 के दशक के अंत में शुरू हुआ। कई मामलों में, शोधकर्ताओं ने मौजूदा प्रोटीन में बदलाव किया, ताकि वे खतरनाक पदार्थों को तोड़ने या रासायनिक निर्माण उद्योग में उपकरण के रूप में काम करने जैसे काम कर सकें।
हालाँकि, प्राकृतिक प्रोटीन की सीमा सीमित है। पूरी तरह से नए कार्यों वाले प्रोटीन प्राप्त करने की क्षमता बढ़ाने के लिए, बेकर का शोध समूह उन्हें बिल्कुल नए सिरे से बनाना चाहता था। जैसा कि बेकर ने कहा,
“यदि आप एक हवाई जहाज बनाना चाहते हैं, तो आप एक पक्षी को संशोधित करके शुरू नहीं करते हैं; इसके बजाय, आप वायुगतिकी के पहले सिद्धांतों को समझते हैं और उन सिद्धांतों से उड़ान मशीनें बनाते हैं।”
एक अनोखा प्रोटीन प्रकाश में आया
जिस क्षेत्र में पूरी तरह से नए प्रोटीन का निर्माण किया जाता है उसे डे नोवो डिज़ाइन कहा जाता है। शोध समूह ने एक पूरी तरह से नई संरचना वाला प्रोटीन बनाया और फिर रोसेट्टा से गणना करवाई कि किस प्रकार का एमिनो एसिड अनुक्रम वांछित प्रोटीन का परिणाम हो सकता है। ऐसा करने के लिए, रोसेट्टा ने सभी ज्ञात प्रोटीन संरचनाओं के डेटाबेस की खोज की और प्रोटीन के छोटे टुकड़ों की तलाश की, जिनकी वांछित संरचना के साथ समानता थी। प्रोटीन के ऊर्जा परिदृश्य के मूलभूत ज्ञान का उपयोग करते हुए, रोसेट्टा ने फिर इन टुकड़ों को अनुकूलित किया और एक एमिनो एसिड अनुक्रम प्रस्तावित किया।
यह जांचने के लिए कि सॉफ्टवेयर कितना सफल रहा, बेकर के शोध समूह ने बैक्टीरिया में प्रस्तावित एमिनो एसिड अनुक्रम के लिए जीन पेश किया जो वांछित प्रोटीन का उत्पादन करता था। फिर उन्होंने एक्स-रे क्रिस्टलोग्राफी का उपयोग करके प्रोटीन संरचना निर्धारित की।
यह पता चला कि रोसेट्टा वास्तव में प्रोटीन का निर्माण कर सकता है। शोधकर्ताओं द्वारा विकसित प्रोटीन, टॉप 7, की संरचना लगभग वैसी ही थी जैसी उन्होंने डिज़ाइन की थी।
बेकर की प्रयोगशाला से शानदार रचनाएँ
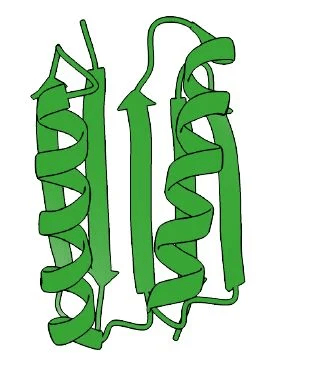
प्रोटीन डिजाइन पर काम कर रहे शोधकर्ताओं के लिए Top7 एक अप्रत्याशित घटना थी। जिन लोगों ने पहले डे नोवो प्रोटीन बनाए थे, वे केवल मौजूदा संरचनाओं की नकल कर पाए थे। Top7 की अनूठी संरचना प्रकृति में मौजूद नहीं थी। साथ ही, अपने 93 अमीनो एसिड के साथ, यह प्रोटीन डे नोवो डिजाइन का उपयोग करके पहले उत्पादित किसी भी चीज़ से बड़ा था। बेकर ने 2003 में अपनी खोज प्रकाशित की। यह किसी ऐसी चीज़ में पहला कदम था जिसे केवल एक असाधारण विकास के रूप में वर्णित किया जा सकता है;
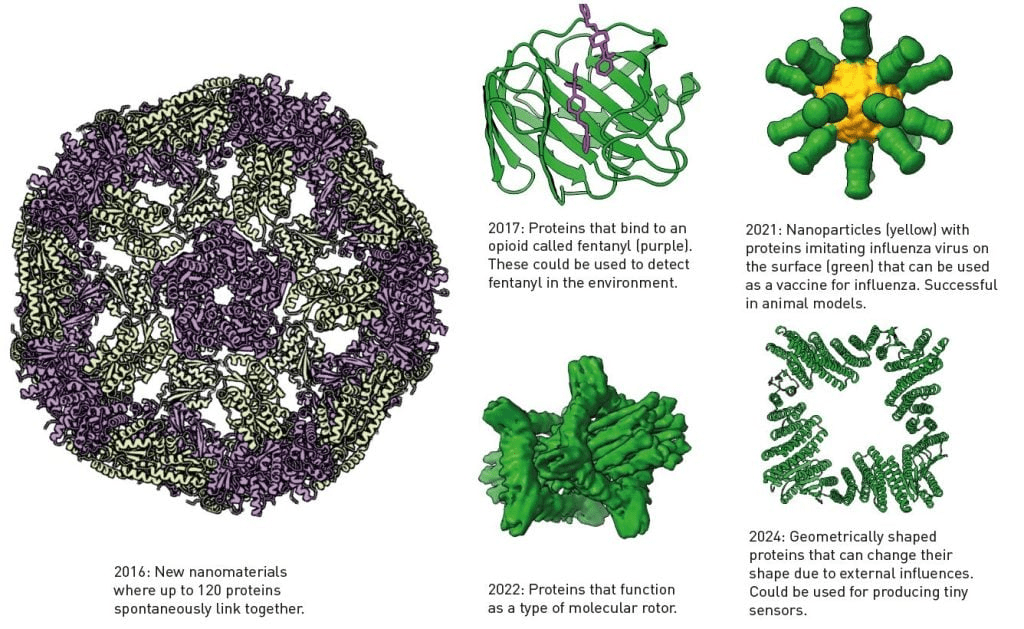
बेकर की प्रयोगशाला में बनाए गए कई शानदार प्रोटीन में से कुछ को चित्र में देखा जा सकता है। उन्होंने रोसेटा के लिए कोड भी जारी किया, इसलिए एक वैश्विक शोध समुदाय ने सॉफ़्टवेयर को विकसित करना जारी रखा है, जिससे अनुप्रयोग के नए क्षेत्र मिल रहे हैं। रसायन विज्ञान में नोबेल पुरस्कार 2024 के ढीले सिरों को बांधने का समय आ गया है। अब क्या?
जो काम पहले सालों में होता था, अब बस कुछ मिनटों में हो जाता है
जब डेमिस हसबिस और जॉन जम्पर ने पुष्टि की कि अल्फाफोल्ड2 वास्तव में काम करता है, तो उन्होंने सभी मानव प्रोटीन की संरचना की गणना की। फिर उन्होंने लगभग सभी 200 मिलियन प्रोटीन की संरचना की भविष्यवाणी की, जिन्हें शोधकर्ताओं ने पृथ्वी के जीवों का मानचित्रण करते समय अब तक खोजा है।
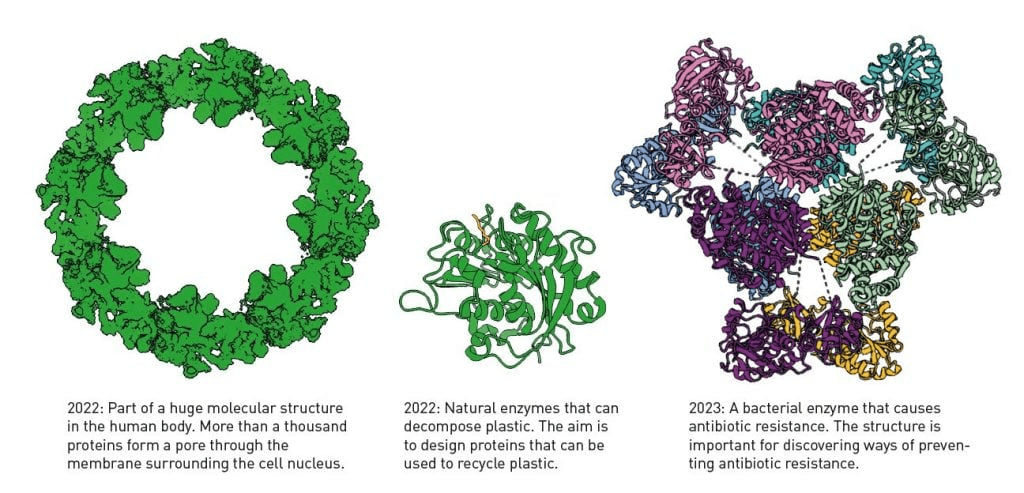
Google DeepMind ने अल्फाफोल्ड2 के लिए कोड को सार्वजनिक रूप से उपलब्ध कराया है, और कोई भी इसे एक्सेस कर सकता है। शोधकर्ताओं के लिए AI मॉडल एक सोने की खान बन गया है। अक्टूबर 2024 तक, अल्फाफोल्ड2 का उपयोग 190 देशों के दो मिलियन से अधिक लोगों द्वारा किया गया था। पहले, प्रोटीन संरचना प्राप्त करने में अक्सर वर्षों लग जाते थे, यदि बिल्कुल भी। अब यह कुछ ही मिनटों में किया जा सकता है। AI मॉडल सही नहीं है, लेकिन यह अपने द्वारा उत्पादित संरचना की शुद्धता का अनुमान लगाता है, इसलिए शोधकर्ताओं को पता है कि भविष्यवाणी कितनी विश्वसनीय है। चित्र 5 कई उदाहरणों में से कुछ दिखाता है कि अल्फाफोल्ड2 शोधकर्ताओं की कैसे मदद करता है।
2020 CASP प्रतियोगिता के बाद, जब डेविड बेकर को ट्रांसफॉर्मर-आधारित AI मॉडल की क्षमता का एहसास हुआ, तो उन्होंने रोसेट्टा में एक जोड़ा, जिसने प्रोटीन के डे नोवो डिज़ाइन को भी सुविधाजनक बनाया है। हाल के वर्षों में, बेकर की प्रयोगशाला से एक के बाद एक अविश्वसनीय प्रोटीन निर्माण सामने आए हैं।
मानव जाति के लाभ के लिए आश्चर्यजनक विकास
रासायनिक उपकरण के रूप में प्रोटीन की अद्भुत बहुमुखी प्रतिभा जीवन की विशाल विविधता में परिलक्षित होती है। यह कि हम अब इन छोटी आणविक मशीनों की संरचना को इतनी आसानी से देख सकते हैं, यह आश्चर्यजनक है; यह हमें बेहतर ढंग से समझने की अनुमति देता है कि जीवन कैसे कार्य करता है, जिसमें कुछ बीमारियाँ क्यों विकसित होती हैं, एंटीबायोटिक प्रतिरोध कैसे होता है या कुछ सूक्ष्मजीव प्लास्टिक को कैसे विघटित कर सकते हैं।
नए कार्यों से भरे प्रोटीन बनाने की क्षमता भी उतनी ही आश्चर्यजनक है। इससे नए नैनोमटेरियल, लक्षित फार्मास्यूटिकल्स, टीकों का अधिक तेज़ी से विकास, न्यूनतम सेंसर और एक हरित रासायनिक उद्योग हो सकता है – ये कुछ ऐसे अनुप्रयोग हैं जो मानव जाति के लिए सबसे अधिक लाभकारी हैं।
क्या आप जानते है ?
- 1901 से अब तक रसायन विज्ञान में 115 नोबेल पुरस्कार प्रदान किये जा चुके हैं।
- 26 रसायन विज्ञान पुरस्कार दो पुरस्कार विजेताओं द्वारा साझा किए गए हैं।
- अब तक 8 महिलाओं को रसायन विज्ञान पुरस्कार से सम्मानित किया जा चुका है।
- 2 लोगों, फ्रेडरिक सेंगर और बैरी शार्पलेस को दो बार रसायन विज्ञान पुरस्कार से सम्मानित किया गया है।
- अब तक के सबसे कम उम्र के रसायन विज्ञान पुरस्कार विजेता फ्रेडरिक जूलियट की उम्र 35 वर्ष थी, जिन्हें 1935 में नोबेल पुरस्कार से सम्मानित किया गया था।
- 97 सबसे उम्रदराज रसायन विज्ञान पुरस्कार विजेता और अब तक के सबसे उम्रदराज पुरस्कार विजेता, जॉन बी. गुडइनफ की उम्र थी।